文章出處:行業(yè)干貨 網(wǎng)責任編輯: 金飛鷹 閱讀量: 發(fā)表時間:2025-07-01
如題,企業(yè)如果先對產(chǎn)品進行滅菌送檢,再進行滅菌驗證(保證送檢產(chǎn)品滅菌的參數(shù)和滅菌驗證的參數(shù)一樣),這樣是否可行?
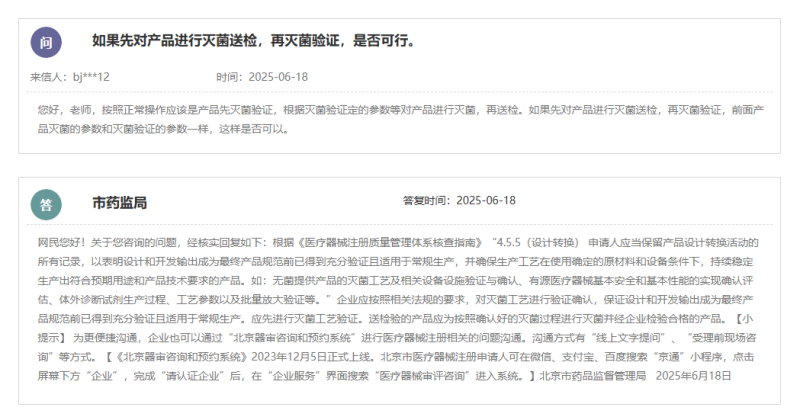
根據(jù)北京市藥監(jiān)局的答復,根據(jù)《醫(yī)療器械注冊質(zhì)量管理體系核查指南》“4.5.5(設計轉(zhuǎn)換) 申請人應當保留產(chǎn)品設計轉(zhuǎn)換活動的所有記錄,以表明設計和開發(fā)輸出成為最終產(chǎn)品規(guī)范前已得到充分驗證且適用于常規(guī)生產(chǎn),并確保生產(chǎn)工藝在使用確定的原材料和設備條件下,持續(xù)穩(wěn)定生產(chǎn)出符合預期用途和產(chǎn)品技術(shù)要求的產(chǎn)品。如:無菌提供產(chǎn)品的滅菌工藝及相關設備設施驗證與確認、有源醫(yī)療器械基本安全和基本性能的實現(xiàn)確認評估、體外診斷試劑生產(chǎn)過程、工藝參數(shù)以及批量放大驗證等。”企業(yè)應按照相關法規(guī)的要求,對滅菌工藝進行驗證確認,保證設計和開發(fā)輸出成為最終產(chǎn)品規(guī)范前已得到充分驗證且適用于常規(guī)生產(chǎn)。應先進行滅菌工藝驗證。送檢驗的產(chǎn)品應為按照確認好的滅菌過程進行滅菌并經(jīng)企業(yè)檢驗合格的產(chǎn)品。
? 無源產(chǎn)品貨架有效期變更,需進行質(zhì)量管理體系核查嗎?
醫(yī)療器械注冊咨詢認準金飛鷹
深圳:0755-86194173
廣州:020 - 82177679
四川:028 - 68214295
湖南:0731-22881823
湖北:181-3873-5940
江蘇:135-5494-7827
廣西:188-2288-8311
海南:135-3810-3052
重慶:135-0283-7139