文章出處:行業(yè)干貨 網責任編輯: 金飛鷹 閱讀量: 發(fā)表時間:2025-04-24
由于某些客觀環(huán)境的影響,近期跟我們咨詢東南亞注冊的企業(yè)較多,事實上,此前我們已經跟大家分享過泰國及新加坡注冊的相關內容,那么本期文章我們繼續(xù)聚焦馬來西亞市場,為大家?guī)眈R來西亞醫(yī)療器械注冊全流程詳解。
馬來西亞的醫(yī)療器械產品注冊由馬來西亞衛(wèi)生部(MoHM)的醫(yī)療器械管理局(MDA)監(jiān)督。馬來西亞醫(yī)療器械注冊涉及到的主要法規(guī)有Medical Device Act 2012(Act 737)及Medical Device Regulations 2012,根據(jù)以上法規(guī),所有在馬來西亞生產、進口的醫(yī)療器械產品都必須在MDA進行注冊后方可進入市場。對于進口的醫(yī)療器械生產商而言,需找到授權代理(authorized represetative,AR)完成注冊事宜。
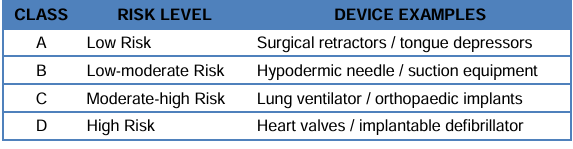
馬來西亞采用基于風險的分類系統(tǒng),將醫(yī)療器械分為 A、B、C、D 四個等級:
A類(低風險):如手術牽開器、壓舌板
B類(中低風險):如皮下注射針、抽吸設備
C類(中高風險):如肺呼吸機、骨科植入物
D類(高風險):心臟瓣膜、可植入除顫器
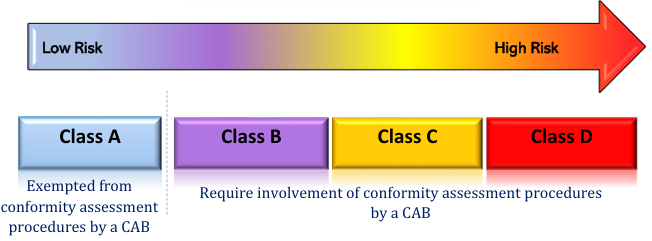
在馬來西亞,低風險的A類器械可以直接向當局遞交相關申請;而較高風險的B、C、D類產品則需要先由第三方機構CAB(Conformity Assessment Body)執(zhí)行符合性評價,才可以遞交注冊申請。CAB在對技術文件、質量管理體系(需符合ISO 13485質量管理體系)進行審核之后,會為廠家頒發(fā)證書。
馬來西亞當局對技術文件的要求可以參考東盟共同提交檔案模板(CSDT)。值得注意的是,產品標簽和使用說明書必須用馬來語,包括產品名稱、型號、制造商信息、有效期、使用說明和警告等。
另外,馬來西亞為獲得他國批準的制造商引入了市場準入的簡化路線,特別是已經通過符合性評估并在澳大利亞、加拿大、歐盟、日本、美國、英國被認可的國家獲得批準的產品,CAB審查過程將簡化。
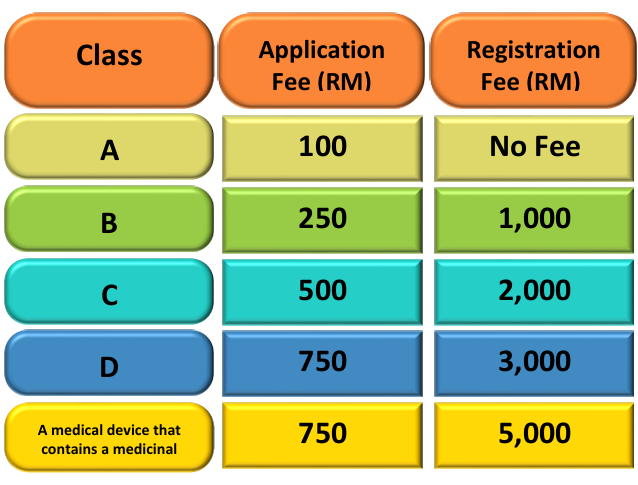
MDA審核時間視情況而定,大約需要1至6個月。不同類別的產品收費不同,具體費用參見下圖。在注冊通過之后,獲得的注冊證有效期為五年。
以上就是我們本期分享的有關馬來西亞注冊相關內容,接下來還會繼續(xù)分享其他東南亞國家的注冊專題,記得持續(xù)關注哦~另外,假如您還想了解哪個國家的醫(yī)療器械注冊流程,歡迎給我們留言,我們會優(yōu)先安排
醫(yī)療器械注冊咨詢認準金飛鷹
深圳:0755-86194173
廣州:020 - 82177679
四川:028 - 68214295
湖南:0731-22881823
湖北:181-3873-5940
江蘇:135-5494-7827
廣西:188-2288-8311
海南:135-3810-3052
重慶:135-0283-7139