文章出處:法規(guī)動(dòng)態(tài) 網(wǎng)責(zé)任編輯: 金飛鷹 閱讀量: 發(fā)表時(shí)間:2024-10-11
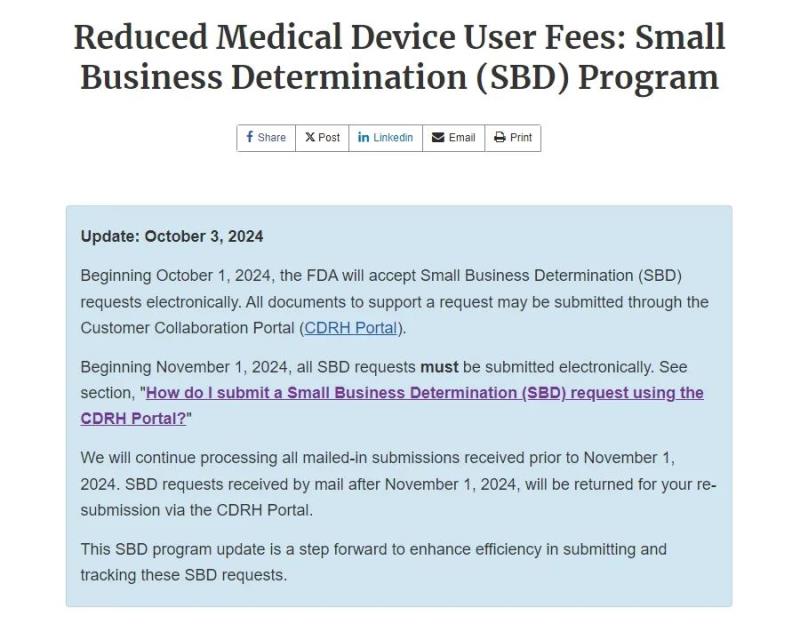
近日,F(xiàn)DA發(fā)布了最新公告,自2024年11月1日起,所有小企業(yè)資質(zhì)申請(qǐng)(Small Business Determination,SBD)必須通過(guò)FDA的CDRH客戶協(xié)作門戶(CDRH Portal)進(jìn)行電子提交。此舉旨在提高申請(qǐng)效率,縮短審批周期,并加強(qiáng)整個(gè)申請(qǐng)過(guò)程的透明度。
公告提到,從2024年10月1日開(kāi)始,F(xiàn)DA將接受電子形式的小企業(yè)認(rèn)定(SBD)請(qǐng)求。支持請(qǐng)求的所有文件都可以通過(guò)Customer Collaboration Portal(CDRH Portal) 提交。
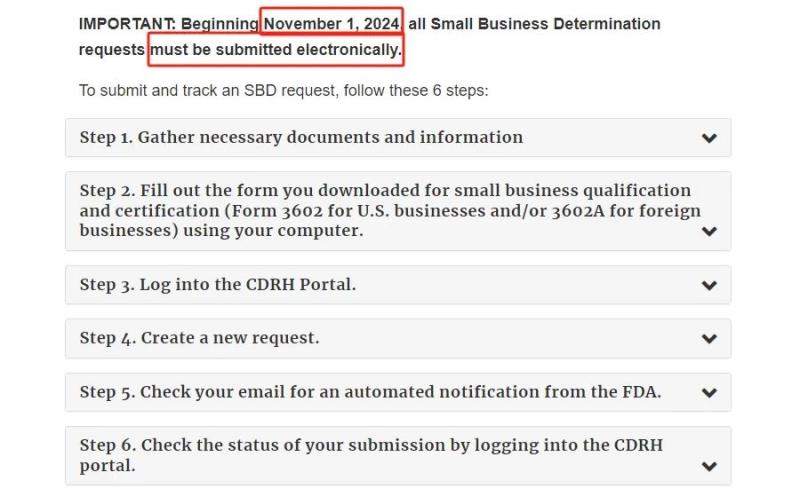
自2024年11月1日起,F(xiàn)DA將停止接受紙質(zhì)郵寄形式的SBD申請(qǐng),所有紙質(zhì)提交的申請(qǐng)將被退回,并要求重新通過(guò)電子化渠道進(jìn)行提交。這意味著申請(qǐng)人必須通過(guò)FDA的CDRH門戶網(wǎng)站上傳所有申請(qǐng)資料,包括必要的稅務(wù)文件和認(rèn)證表格,提交和跟蹤SBD申請(qǐng)的具體步驟如下:
? 收集必要的文件和信息。 ? 填寫(xiě)下載的小型企業(yè)資格和認(rèn)證表格(美國(guó)企業(yè)填寫(xiě)FDA 3602表格,國(guó)外企業(yè)填寫(xiě)FDA 3602A表格)。 ? 登錄CDRH門戶。 ? 創(chuàng)建新請(qǐng)求。 ? 檢查電子郵件中是否有來(lái)自FDA的自動(dòng)通知。 ? 登錄CDRH門戶檢查提交狀態(tài)。
中國(guó)制造商如果符合小企業(yè)的資質(zhì)申請(qǐng)標(biāo)準(zhǔn)(在最近一個(gè)納稅年度的總收入和銷售額低于1億美元),可享受多種FDA申請(qǐng)費(fèi)用的減免優(yōu)惠,包括510(k)申請(qǐng)、De Novo申請(qǐng)、上市前批準(zhǔn)(PMA)申請(qǐng)等,但前提是需由國(guó)家稅務(wù)機(jī)關(guān)完成相應(yīng)的認(rèn)證程序。另外值得注意的是,小企業(yè)資質(zhì)僅限本財(cái)年使用,新的財(cái)年則需要重新申請(qǐng)。
所有通過(guò)CDRH Portal提交的SBD申請(qǐng)可以在門戶網(wǎng)站上實(shí)時(shí)查看進(jìn)度。FDA將在收到申請(qǐng)后的60個(gè)自然日內(nèi)完成審核,并通過(guò)電子郵件向申請(qǐng)人發(fā)送審核結(jié)果。這將有助于中國(guó)企業(yè)更好地把握申請(qǐng)的時(shí)間節(jié)點(diǎn),為后續(xù)產(chǎn)品注冊(cè)流程做好準(zhǔn)備。
金飛鷹在美國(guó)醫(yī)療器械注冊(cè)方面有著豐富案例,包括但不限于FDA 510(k)申請(qǐng)、FDA企業(yè)注冊(cè)、一類產(chǎn)品列名、QSR 820體系建立維護(hù)、FDA驗(yàn)廠咨詢、美國(guó)UDI申請(qǐng)、鄧白氏碼申請(qǐng)、美國(guó)代理人服務(wù)等,假如您有美國(guó)注冊(cè)相關(guān)需求,記得聯(lián)系我們,我們將全程為您提供高效周到的服務(wù)~
醫(yī)療器械工藝驗(yàn)證,一定要委托有資質(zhì)的第三方機(jī)構(gòu)進(jìn)行檢驗(yàn)嗎? 臨床試驗(yàn)若采用平行對(duì)照設(shè)計(jì),選擇對(duì)照產(chǎn)品應(yīng)遵循什么原則? 醫(yī)療器械注冊(cè)證/生產(chǎn)許可證快到期了,應(yīng)何時(shí)提出延續(xù)申請(qǐng)?
醫(yī)療器械注冊(cè)咨詢認(rèn)準(zhǔn)金飛鷹 深圳:0755-86194173 廣州:020 - 82177679 四川:028 - 68214295 湖南:0731-22881823 湖北:181-3873-5940 江蘇:135-5494-7827 廣西:188-2288-8311 海南:135-3810-3052