韓國KFDA注冊
- 立即咨詢
-
全國服務熱線:
400-888-7587

400-888-7587
? 辦理介紹:
? 韓國衛(wèi)生福利部(MinistryofHealthandWelfare,MHW),簡稱衛(wèi)生部,主要負責管食品,藥品、化妝品和醫(yī)療器械的管理,是最主要的衛(wèi)生保健部門。依照《醫(yī)療器械法》,韓國衛(wèi)生福利部下屬的食品藥品安全部(MinistryofFoodandDrugSafety,MFDS)負責對醫(yī)療器械的監(jiān)管工作。
? 韓國醫(yī)療器械法把醫(yī)療器械分為4類(Ⅰ、Ⅱ、Ⅲ、Ⅳ),這種分類方法與歐盟對醫(yī)療器械的分類方法非常相似。
Ⅰ類:幾乎沒有潛在危險的醫(yī)療器械;
Ⅱ類:具有低潛在危險的醫(yī)療器械;
Ⅲ類:具有中度潛在危險的醫(yī)療器械;
Ⅳ類:高風險的醫(yī)療器械。
? 醫(yī)療器械分類依據(jù):危險程度、與人體的接觸面積和接觸時間、產(chǎn)品的安全性和有效性。
? 韓國KFDA的技術文件準備:
? 技術文件包含有關醫(yī)療設備設計,材料,預期用途,制造方法等的信息。韓國技術文件類似于EuropeanTechnical File或US FDA 510(k)提交。 II類及更高版本的設備需要提交其技術文件的測試信息,大多數(shù)產(chǎn)品將需要額外的性能測試以滿足韓國的要求。此外,除標準應用外,IV類設備還需要提交技術文檔摘要(STED)。
? 使用新技術或?qū)嵸|(zhì)性注冊等同(SE)的II,III和IV醫(yī)療設備需要將臨床數(shù)據(jù)提交給MFDS進行審查,此外還要提供標準技術文件。臨床數(shù)據(jù)審查申請(以前稱為安全和有效審查 - SER)是一種綜合的提交類型,類似于歐洲的設計文檔或美國FDA的PMA提交。
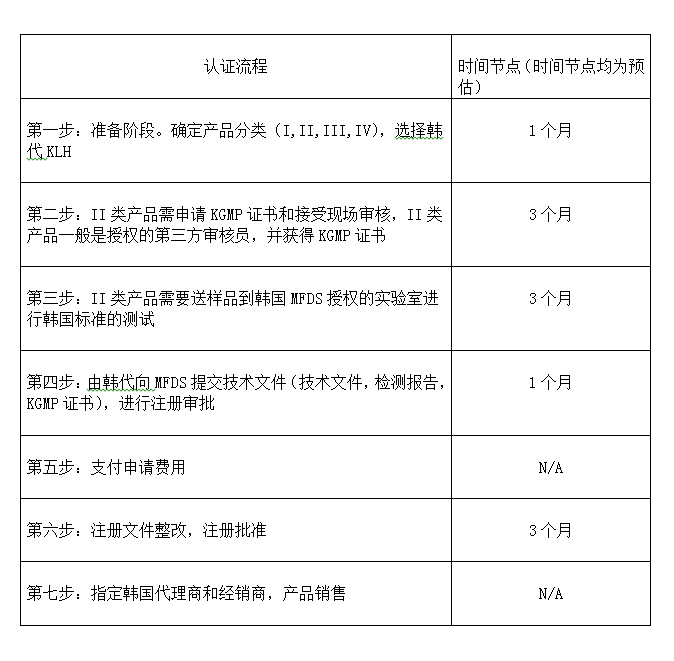
? 辦理流程 / Processing process
? 金飛鷹相關服務 / Golden Eagle related services
● 通過合作公司提供產(chǎn)品注冊全流程注冊服務
● 體系認證及驗廠服務
● 產(chǎn)品上市后的監(jiān)管服務
全面解決您的研發(fā)、生產(chǎn)、驗收、營銷全流程問題

practical experience
2000多個二、三類醫(yī)械項目經(jīng)驗沉淀,為你分配做過相同案例的實戰(zhàn)老師。
Professional translation
匯聚7大語種專業(yè)翻譯精英,多年醫(yī)械行業(yè)翻譯經(jīng)驗,能準確翻譯專業(yè)名詞及用語。
Software development
強大的軟件研發(fā)團隊,已為集團研發(fā)出成熟的項目管理軟件,可提供軟件定制服務。
Group supply chain
嚴選數(shù)十個優(yōu)秀的醫(yī)械行業(yè)服務機構,可為客戶推薦更實惠的醫(yī)械配套服務。
多次創(chuàng)造二三類高風險產(chǎn)品一次性通過的行業(yè)紀錄
項目狀態(tài):已結案
項目輔導老師:李老師
項目狀態(tài):已結案
項目輔導老師:車老師
項目狀態(tài):已結案
項目輔導老師:王老師
項目狀態(tài):已結案
項目輔導老師:黃老師